#文献分享# 分子界的杀手媒婆——Aptamer介导的蛋白降解
推荐语

这篇文章介绍了一种通用目标蛋白降解策略,方法其实挺简单。原理是aptamer 连上N‑Degron,这样就可以将aptamer识别的目标蛋白通过泛素化途径降解。其实类似的方案有挺多的,基于aptamer的PROTAC,LYTAC等等。
Aptamer只不过就是一个识别工具而已,放在不同的地方,可以发挥不同的功能。我们筛选了多种重要蛋白的aptamer,如果您希望利用aptamer来进行PROTAC类似的工作,可以与我们合作。
文章末尾我们列出了2023年以来的部分基于aptamer的PROTAC文献,供参考。
今天给大家分享一篇发表在ACS Chemical Biology上的文章“Aptamer and N‑Degron Ensemble (AptaGron) as a Target Protein Degradation Strategy”,该研究建立了适配体与N-degron组合系统(AptaGron),成功降解 Tau、nucleolin和eIF4E这三种缺乏小分子配体的目标蛋白,有力彰显 AptaGron作为靶向蛋白降解稳健平台的潜力,为攻克蛋白降解难题提供创新思路与实用工具
研究背景
靶向蛋白降解(Target Protein Degradation,TPD)是针对“不可成药”蛋白治疗很有前景的策略,超 85%蛋白因缺乏明确配体结合口袋结构而“不可成药”。虽多种 TPD 策略涌现,但发现靶蛋白特异性配体仍是主要难题,现有策略在靶蛋白结合环节受阻。适配体可通过SELEX系统筛选结合靶点,寡核苷酸细胞内递送方法成熟,但此前在 TPD 研究中利用有限,且每个降解分子需在适配体与 E3 连接酶结合配体间单独偶联,开发简单稳健的降解分子衍生方法至关重要。
研究目的
本文旨在设计一种由适配体和N-降解决定子 PNA 构成的组合系统,作为简单且稳健的靶向蛋白降解策略。借助互补序列杂交优势,将其应用于任何经 SELEX 筛选出适配体的目标蛋白。
研究内容
1.AptaGron 系统设计原理与构建

图 1.传统蛋白水解靶向嵌合体(PROTAC)方法与AptaGron系统的示意图比较。
AptaGron 系统由适配体与含N-degron肽的肽核酸(PNA)杂交组成。N-degron肽基于含精氨酸的N端肽设计,添加 RLAAAC 接头与适配体 5′端互补序列,还设计不同长度(9和18nt)及序列组成(AT丰富和GC丰富)的接头系列,利用细胞N端规则途径降解蛋白。
选tau、nucleolin和eIF4E三种缺乏选择性小分子配体且疾病关联明确的蛋白,且亚细胞定位不同,tau和eIF4E在细胞质中,nucleolin在核内。
2.AptaGron 系统稳定性、接头优化及降解效果研究

图 2.(a)AptaGron 系统示意图。(b)wtaptamertau、GC18ntaptamertau 和杂交的GC18ntAptaGrontau在磷酸盐缓冲盐水(PBS)缓冲液(pH 7.4)中的稳定性概况。(c)在长达 48 小时的细胞裂解液暴露下 AptaGron 的稳定性。
在 PBS 和细胞裂解液中检测AptaGron稳定性,发现48小时内无显著降解,细胞裂解液中半衰期24小时。用含不同接头的AptaGron降解tau蛋白,18nt长接头比9nt更有效,确定18nt接头系统用于后续研究。
3.tau 蛋白降解研究

图 2.(d)AptaGron对tau的TPD。(e)在连续孵育时间下施用GC18ntAptaGrontau后,表达Tau-GFP的HEK293T细胞的荧光活细胞图像。(f)经GC18ntAptaGrontau处理后,表达Tau-GFP的HEK293T细胞的活细胞图像的荧光信号定量值的柱状图。(g)用GC18ntAptaGrontau处理后Tau-GFP的荧光信号显示的降解情况。(h)使用ImageJ对PAGE图像的荧光信号进行定量。
神经元内Tau纤维缠结沉积是众多神经退行性疾病关键标志,纤维状Tau积聚引发神经毒性,促使开发消除Tau纤维缠结疗法。在AptaGron系统中,经连接子优化,以TauP301L转基因小鼠脑蛋白组验证,AptaGron可降解动物样本中外源过表达及内源性Tau,且对致聚集突变体TauP301L有效。于活细胞中,因适配体负电致细胞通透性差,经脂质体转染递送AptaGron,监测表达Tau-GFP的HEK293T细胞发现其降低 Tau 表达,活细胞荧光成像与PAGE分析确证降解,虽受递送试剂细胞毒性限制剂量范围,但数十微摩尔浓度仍有效。
4. nucleolin 和 eIF4E 降解研究
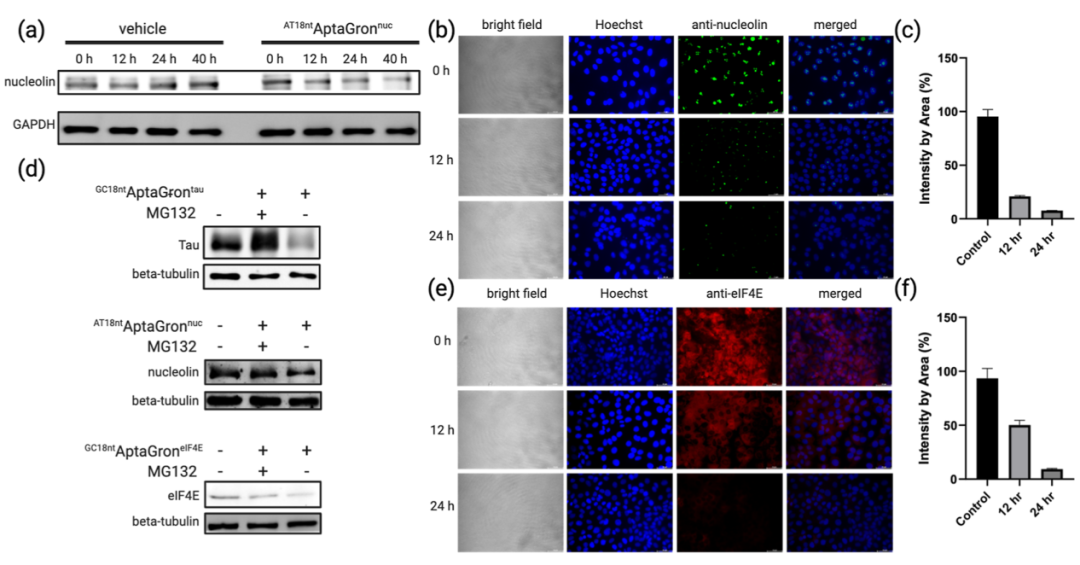
图 3. (a)给予浓度为 10 μM 的AT18ntAptaGronnuc 处理 40 小时后,对核仁素降解情况的WB分析。(b)用浓度为 10 μM 的AT18ntAptaGronnuc处理 MCF7 细胞后的免疫细胞化学图像。(c)从免疫细胞化学获得的荧光强度分布柱状图。(d)对 tau、核仁素和eIF4E的WB分析,以及有无蛋白酶体抑制剂MG132共同处理的情况。(e)用浓度为10 μM的GC18ntAptaGroneIF4E处理 MCF7 细胞后的免疫细胞化学图像。(f)免疫细胞化学图像的荧光强度柱状图。
将先前报道的nucleolin及eIF4E的适配体添加18 nt 连接子构建AptaGron。鉴于nucleolin适配体含重复GGT序列,选富含AT的连接子构建AT18ntAptaGronnucleolin,经热退火制得复合物后用于 MCF7乳腺癌细胞裂解液,蛋白质印迹分析显示nucleolin降解条带强度随孵育时间降低。用转染试剂测试细胞递送,12小时后检测到其表达下调且呈剂量依赖性,免疫细胞化学图像表明核仁素定位细胞核,孵育中染色信号强度与绿色斑点数量减少。
用富含GC 的18 nt连接子制得GC18ntAptaGroneIF4E,体外可降解eIF4E,加蛋白酶体抑制剂MG132可抑制降解,表明此过程依赖泛素-蛋白酶解。将其用转染试剂递送至活细胞,12小时和24小时出现类似下调模式及剂量依赖性反应,免疫细胞化学图像确证eIF4E位于细胞质,蛋白质印迹与免疫细胞化学法均持续检测到降解。
5. AptaGron 系统特性及优势分析

图 S8. 用于三元复合物形成的免疫沉淀蛋白质印迹分析(IP-WB)
降解机制与复合物形成验证:确认通过“UBR1-AptaGron-靶蛋白”三元复合物实现降解,不改变靶蛋白 mRNA 转录水平,虽然PNA 接头序列可能有脱靶效应,但 AptaGron 的 PNA:DNA 杂交结合熔解温度高,生理条件下不易解离。

图 S10. AptaGron与免疫调节药物来那度胺(CRBN)配体偶联适配体之间靶蛋白降解情况对比。
与传统 PROTAC 对比优势:在CRBN E3连接酶低表达细胞中,AptaGron 比传统 CRBN-配体 PROTAC 具优势,为E3连接酶低表达、无合适的配体或靶蛋白配体未确定情况提供替代方案。
研究结论与展望
AptaGron 方法具有作为一个可靠的靶向蛋白降解平台的潜力,后续可以从提升靶选择性和降解效率需开发高亲和力适配体,优化 N-degron PNA结合亲和力,精心设计PNA接头减少脱靶效应,改进细胞摄取方式等方面进行优化。同时探索细胞穿透肽等技术改进细胞摄取,推动 AptaGron 技术升级,拓展其在疾病治疗中靶向蛋白降解的应用前景。
参考文献
1 Feng, Z. T. et al. Development of hybrid aptamers-engineered PROTACs for degrading VEGF165 in both tumor- and vascular endothelial cells. European Journal of Medicinal Chemistry 281, doi:10.1016/j.ejmech.2024.117027 (2025).
2 Ying, S. et al. Selective and Orally Bioavailable c-Met PROTACs for the Treatment of c-Met-Addicted Cancer. J Med Chem, doi:10.1021/acs.jmedchem.3c02417 (2024).
3 Wang, Y. C. et al. Antitumor Effect of Anti-c-Myc Aptamer-Based PROTAC for Degradation of the c-Myc Protein. Advanced Science 11, doi:10.1002/advs.202309639 (2024).
4 Wang, C., Zhang, Y. J., Yu, W. P., Xu, J. Z. & Xing, D. M. PROTAC-biomacromolecule conjugates for precise protein degradation in cancer therapy: A review. International Journal of Biological Macromolecules 261, doi:10.1016/j.ijbiomac.2024.129864 (2024).
5 Kong, L. P. et al. An engineered DNA aptamer-based PROTAC for precise therapy of p53-R175H hotspot mutant-driven cancer. Science Bulletin 69, 2122-2135, doi:10.1016/j.scib.2024.05.017 (2024).
6 He, S. P. et al. Drugtamer-PROTAC Conjugation Strategy for Targeted PROTAC Delivery and Synergistic Antitumor Therapy. Advanced Science 11, doi:10.1002/advs.202401623 (2024).
7 Fu, X. K. et al. Repurposing AS1411 for constructing ANM-PROTACs. Cell Chemical Biology 31, doi:10.1016/j.chembiol.2024.03.011 (2024).
8 Feng, Y. et al. Aptamer Proteolysis-Targeting Chimeras (PROTACs): A Novel Strategy to Combat Drug Resistance in Estrogen Receptor α-Positive Breast Cancer. Acs Pharmacol Transl, doi:10.1021/acsptsci.4c00469 (2024).
9 Xu, Y. et al. The aptamer-based RNA-PROTAC. Bioorg Med Chem 86, 117299, doi:10.1016/j.bmc.2023.117299 (2023).
10 Wang, H. et al. Beyond canonical PROTAC: biological targeted protein degradation (bioTPD). Biomaterials Research 27, doi:10.1186/s40824-023-00385-8 (2023).
11 Tsujimura, H. et al. Development of DNA Aptamer-Based PROTACs That Degrade the Estrogen Receptor. ACS Med Chem Lett 14, 827-832, doi:10.1021/acsmedchemlett.3c00126 (2023).
12 Tamatam, R. & Shin, D. Emerging Strategies in Proteolysis-Targeting Chimeras (PROTACs): Highlights from 2022. International Journal of Molecular Sciences 24, doi:10.3390/ijms24065190 (2023).
13 Shih, P. C., Naganuma, M., Demizu, Y. & Naito, M. Current Status of Oligonucleotide-Based Protein Degraders. Pharmaceutics 15, doi:ARTN 76510.3390/pharmaceutics15030765 (2023).
14 Liu, R. et al. Cooperatively designed aptamer-PROTACs for spatioselective degradation of nucleocytoplasmic shuttling protein for enhanced combinational therapy. Chemical Science 15, 134-145, doi:10.1039/d3sc04249a (2023).
15 Li, X. et al. c-Myc-Targeting PROTAC Based on a TNA-DNA Bivalent Binder for Combination Therapy of Triple-Negative Breast Cancer. J Am Chem Soc 145, 9334-9342, doi:10.1021/jacs.3c02619 (2023).
16 Kong, L. et al. Selective degradation of the p53-R175H oncogenic hotspot mutant by an RNA aptamer-based PROTAC. Clin Transl Med 13, e1191, doi:10.1002/ctm2.1191 (2023).
17 Chen, Z. Z., Chen, M. H., Liu, R., Fan, H. H. & Zhang, J. J. A cocktail therapeutic strategy based on clofarabine-containing aptamer-PROTAC for enhanced cancer therapy. Chemical Communications 59, 11560-11563, doi:10.1039/d3cc02904b (2023).
18 Chen, C. et al. Recent Advances in Pro-PROTAC Development to Address On-Target Off-Tumor Toxicity. Journal of Medicinal Chemistry 66, 8428-8440, doi:10.1021/acs.jmedchem.3c00302 (2023).
19 Bhole, R. P. et al. Unlocking the potential of PROTACs: A comprehensive review of protein degradation strategies in disease therapy. Bioorganic Chemistry 139, doi:10.1016/j.bioorg.2023.106720 (2023).
Aptamy 10年专注核酸适配体筛选!
提供适配体筛选、亲和力检测等技术服务,合作咨询:

微信号丨aptamerHF
电话丨13965674386
官网丨www.aptamy.com
点击下方阅读原文